Kongressbericht zur Jahrestagung der ASCO 2016
Chicago, 3.6.-7.6.2016
Dr. med. Ahmad Haider
Facharzt für Urologie/Andrologie
Einleitung
In diesem Kongressbericht von der Jahrestagung 2016 der ASCO in Chicago präsentieren wir Ihnen eine Auswahl der wichtigsten Arbeiten, die zu den Themengebieten Harnblasen Urothelkarzinom und Prostatakarzinom vorgestellt wurden.
Auf dem diesjährigen Kongress der ASCO in Chicago stand beim metastasierten Harnblasenkarzinom die Immuntherapie im Mittelpunkt der Aufmerksamkeit. Sie findet mit Atezolizumab möglicherweise schon bald den Weg in die Firstline-Therapie. Dennoch gab es auch andere interessante Studienergebnisse. So wurden beispielsweise Ergebnisse einer deutschen chirurgischen Studie zum Harnblasenkarzinom vorgestellt.
Beim Prostatakarzinom werden wir Ihnen die Ergebnisse der FIRSTANA-Studie zum Einsatz von Cabazitaxel, die Ergebnisse der SPCG-12-Studie zur adjuvanten Therapie mit Docetaxel und die PROMI-Studie zur Bedeutung des MRT in der Diagnostik kurz vorstellen.
Bei Hodentumoren bildete die Frage nach dem Vorgehen bei mangelhaftem Markerabfall einen Schwerpunkt.
Fokusthema: Harnblasen Urothelkarcinom
Atezolizumab als Erstlinientherapie beim Harnblasen Urothelkarzinom (#LBA4500)1
In der Studie wurden 119 Patienten beobachtet. Die Einschlusskriterien waren folgende: chemonaiv, GRF < 60 und ECOG 2. Das mediane Alter betrug 73 Jahre, wobei 21 % der Patienten über 80 Jahre alt waren. Eine vorangegangene Systemtherapie (z. B. neoadjuvant) hatten 18 % der Teilnehmer gemacht, 10 % hatten sich bereits einer Radiotherapie unterzogen, 66 % wiesen viszerale Metastasen auf. Als Therapie erhielten die Teilnehmer Atezolizumab 1.200 mg i.v. q3W. Es kam unter dem Checkpoint-Inhibitor Atezolizumab bei rund einem Viertel der 119 Patienten zu einer Regression des Tumors. Atezolizumab löst eine „Bremse“ des Immunsystems, die verhindert, dass dieses die Tumorzellen attackiert. Die mediane Überlebenszeit betrug 14,8 Monate. Unter den üblichen Carboplatin-basierten Therapien, die eingesetzt werden, wenn Cisplatin nicht infrage kommt, betragen die Überlebenszeiten nur 9 bis 10 Monate. Bei 21 der 28 Patienten (75 %), die auf Atezolizumab ansprachen, hält die Response nach einem medianen Follow-up von 14,4 Monaten derzeit noch an. Die Immuntherapie ist generell gut vertragen worden. Nur 10 % bis 15 % der Behandelten hatten schwerere Nebenwirkungen, die typischerweise Hypothyreoidismus, Leberfunktionsstörungen, Hautausschläge und Diarrhoen umfassten. Nur 6 % brachen die Therapie aufgrund der Toxizität ab. Unter einer Carboplatin-basierten Chemotherapie betragen die Abbruchquoten in der Regel rund 20 %. Fazit
Die Studienergebnisse sind besonders im Hinblick auf die Behandlung älterer Patienten – für die derzeit oft keine guten therapeutischen Alternativen verfügbar sind – ermutigend.
Link zum Abstract: http://meetinglibrary.asco.org/content/170759-176
Sicherheit und Effektivität von Durvalumab beim urothelialen Harnblasenkarzinom (#4502)2
Diese Phase 1B Studie schloss Patienten mit metastasiertem oder inoperablem primäre Urothelzellkarzinom (1st line) ein. Es wurden 44 Patienten mit metastasiertem Urothelzellkarzinom (davon 27 mit viszeralen Metastasen) nach Vortherapie mit Cisplatin beobachtet. Die Patienten wurden unabhängig von der PD-L1 Expression eingeschlossen.
Als Therapie erhielten die Patienten Avelumab (anti-PD-L1 IgG1 Antikörper) 10 mg/kg i. v. alle zwei Wochen bis Progress oder Abbruch. Die Tumor-Beurteilung erfolgte alle sechs Wochen (RECIST 1.1) mit Hilfe der Evaluierung von progressionsfreiem (PFS) und Gesamtüberleben (OS). Bei allen Patienten erfolgte ein medianes Follow-up (FU) nach elf Monaten. Die mediane Anzahl vorheriger Therapien betrug 2. Unerwünschte Nebenwirkungen wurden bei 30 Patienten beobachtet und teilten sich wie folgt auf:
- Infusions assoziierte Reaktion (20,5 %)
- Erbrechen 11,4 %, Übelkeit 20,5 % und Asthenia (11,4 %)
Die Gesamtansprechrate (ORR) betrug 18,2 %. Bei Patienten mit viszeralen Metastasen lag sie bei 18,5 % vs. 17,6 % ohne Metastasen. Das OS nach 12 Monaten lag bei 50,9 %.
Fazit
Durvalumab hat ein akzeptables Sicherheitsprofil mit einer etwas besseren Wirksamkeit beim PD-L1+ metastasierten Urothelzellkarzinom. Viszerale Metastasen sprechen ebenfalls an. Damit ist Durvalumab ein weiterer erfolgversprechender PD-L1 Inhibitor/Antikörper mit ähnlichen Daten wie Atezolizumab oder Durvalomab bzw. Nivolumab als PD-1 Antikörper. Das objektive Ansprechen liegt mit 18 % etwas tiefer als bei den Konkurrenzpräparaten.
Link zum Abstract: http://meetinglibrary.asco.org/content/163749-176
Begrenzte vs. erweiterte Hüft-Lymphadenektomie bei Patienten mit Blasenkrebs, bei denen eine radikale Zystektomie durchgeführt wurde: Überlebensraten (#4503)3
Es handelt sich um die erste randomisierte Studie zur Frage der Extensivität der Lymphadenektomie (LA) bei Patienten mit lokal fortgeschrittenem Blasenkarzinom und Zystektomie. Dazu wurden 375 Patienten mit lokal fortgeschrittenem Urothelzellkarzinom (high grade T1 und cT2-T4a) in 16 deutschen Zentren in der Zeit von 2006-2010 rekrutiert (1:1 randomisiert, limitierte vs. extendierte Lymphadenektomie bei radikaler Zystektomie). Ausgeschlossen wurden Patienten mit neoadjuvanter Chemo-/Radiotherapie. Primärer Endpunkt war das rezidivfreie Überleben (RFS), sekundärer Endpunkt das krebsspezifische Überleben (CSS).
Die Studie zeigte für N = 437 Patienten (davon 375 auswertbar) folgende (intention to treat) ITT Analyse: Bei 49 % der Patienten war der Tumor lokal begrenzt (pT2), bei 24 % waren die Lymphknoten betroffen (pN+). Weitere Daten sind in Tabelle 1 dargestellt.
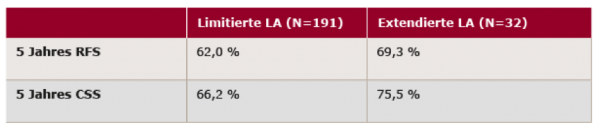
Tabelle 1: 5 Jahres RFS und CSS nach LA3
In den Ergebnissen zeigte sich keine signifikante Verbesserung des RFS und CSS bei extendierter LA in der Gesamtgruppe. In der Subgruppe der organbegrenzten Tumoren < pT2 war eine signifikante Verbesserung des RFS zugunsten der extendierten LA festzustellen. Fazit
Diese Studie ist die erste und größte Studie weltweit in dieser Indikation mit einer sehr hohen Rate an Progressionsfreiheit bei der limitierten LA (62 %). Eine 5-Jahres Rezidivfreiheit von 85 % hatten pT2 Tumore & extendierte LA. Für die Praxis sollte man bei organbegrenzten Urothelblasen-Tumoren < pT2 an die limitierte Lymphadenektomie mit der radikalen Prostatocystektomie denken. Link zum Abstract: http://meetinglibrary.asco.org/content/168539-176
Fokusthema: Prostatakarzinom
Lebensqualität unter Docetaxel – Ergebnisse der CHAARTED-Studie (#5004)4
Die Androgen Deprivation in Kombination mit Docetaxel (ADT+D) verbessert beim metastasierten hormonsensiblen Prostatakarzinom (mHSPC) zwar das OS, doch hat Docetaxel viele unerwünschte Nebenwirkungen. In der vorliegenden Studie wurden die Patienten in die zwei Gruppen ADT + D (6 Zyklen) oder alleinige ADT aufgeteilt. Die Lebensqualität (QOL) der Teilnehmer wurde mittels verschiedener Instrumente gemessen. Hierzu zählten funktionale Bewertung der PCa Therapie (FACT-P), FACT-Taxane, FACIT-Fatigue und Brief Pain Inventory (BPI). Diese wurden jeweils zu Beginn und nach 3, 6, 9 & 12 Monaten durchgeführt. Die abgeleitete QOL wurde in beiden Studienarmen verglichen. Es wurden 790 Patienten randomisiert in ADT+D (N = 397) oder ADT (N = 393), von denen 90 % vor Therapie an der QOL-Bestimmung teilnahmen, 84 % nach 3 Monaten, 74 % nach 9 Monaten und 69 % der Patienten nach 12 Monaten.
In der Auswertung zeigte sich, dass ADT+D der alleinigen ADT mehrfach überlegen war. Die Kombination ADT+D bot den Patienten neben einem Überlebensvorteil auch eine bessere QOL bei mHSPC als unter ADT alleine.
Fazit
Obwohl Docetaxel die erwarteten Beeinträchtigungen der Lebensqualität nach 3 Monaten zur Folge hatte, zeigte sich, dass die Kombination ADT+D nach 12 Monaten eine verbesserte QOL hat. Unklar bleibt, warum die Lebensqualität trotz der Bereinigung um tumorbedingte Symptome nach 12 Monaten besser ist als mit ADT alleine.
Link zum Abstract: http://meetinglibrary.asco.org/content/171187-176
Intermittierende vs. kontinuierliche Docetaxel-Therapie bei Patienten mit CRPC (#5005)5
Zum Zeitpunkt der Rekrutierung der Studie war unklar, ob eine intermittierende Gabe von Docetaxel zur Therapie des CRPC einer kontinuierlichen Gabe gleichwertig ist. Es wurden N = 187 Patienten randomisiert in zwei Arme aufgeteilt. Arm A erhielt Docetaxel intermittierend für 12 Wochen, danach wurde bis zur klinischen Progression (definiert als entweder PSA > 4 ng/ml & 50 % Erhöhung gegenüber Basiswert oder radiologischer oder symptomatischer Progress) pausiert. Arm B erhielt Docetaxel kontinuierlich. Primärer Endpunkt war das 1-Jahres Überleben, welches auf Nicht-Unterlegenheit bei einer 12,5 % Wirksamkeitstoleranz getestet wurde. Sekundäre Endpunkte waren OS, PFS und Zeit bis zum Therapieversagen (TTF).
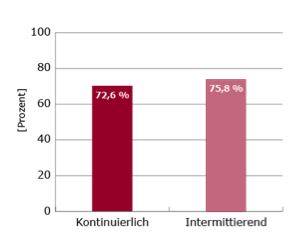
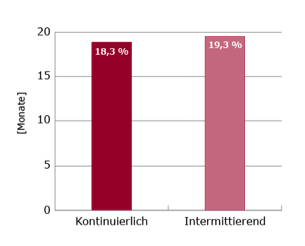
Ausgewertet wurden 78 Patienten in jedem Studienarm. Für das 1-Jahres Überleben wurden 72,6 % (kontinuierlich) vs. 75,8 % (intermittierend) beobachtet. Das mediane OS betrug 18,3 Monate vs. 19,3 Monate (siehe Abb.1).
Abbildung 1: 1-Jahres Überleben (links) und medianes OS (rechts) bei intermittierender vs. kontinuierlicher Docetaxel-Therapie bei Patienten mit CRPC5
Keine signifikanten Unterschiede wurden für PFS und TTF beobachtet. Die mediane Behandlungspause im intermittierenden Arm betrug 15 Wochen.
Es zeigte sich, dass die intermittierende Gabe von Docetaxel der kontinuierlichen Gabe nach einem Jahr Therapie nicht unterlegen war.
Fazit
Die Docetaxel Therapie kann nach 12 Zyklen unterbrochen werden und hat dann keinen Einfluss auf die 1-Jahres Überlebensrate. Allerdings sind deutliche Vorteile bezüglich der Lebensqualität zu erwarten. Aus den großen Docetaxel-Studien weiß man inzwischen, dass eine Gabe über den 10. Zyklus hinaus keinen klinischen Vorteil mehr bringt.
Link zum Abstract: http://meetinglibrary.asco.org/content/170886-176
Cabazitaxel vs. Docetaxel bei Chemotherapie-naiven (CN) Patienten mit mCRPC (FIRSTANA-Studie) (#5006)6
Diese Studie stellte die Frage, ob Cabazitaxel in Dosierungen von 20 mg oder 25 mg IV Q3W + Prednison 10 mg PO QD (C25) der primären Therapie mit 75 mg Docetaxel IV Q3W + P (D75) überlegen ist.
In der multinationalen Phase-3-Studie wurden mCRPC-Patienten (ECOG PS 0-2), die Progression nach Kastration aufwiesen 1:1:1 (C20, C25, D75), randomisiert. Primärer Endpunkt war das OS, sekundäre Endpunkte Sicherheit, PFS, Zeit bis zu Skelett-assoziierten Ereignissen (SRE) und Lebensqualität (HRQOL). 1.168 Patienten wurden im Zeitraum von 2011 bis 2013 randomisiert (C20 = 391, C25 = 389, D75 = 388) und einer medianen Zahl von neun Behandlungszyklen unterzogen. Bezüglich der sekundären Endpunkte führte C25 zu einem besseren Ansprechen des Tumors auf die Medikation, ansonsten wurden keine signifikanten Unterschiede zwischen den Gruppen beobachtet. C20 und C25 sind D75 in Bezug auf das Überleben nicht überlegen. C20 führt allerdings zu einem besseren Ansprechen des Tumors auf die Medikation als die anderen Therapie-Schemata. Fazit Cabazitaxel wurde für Patienten entwickelt, die eine klinische Docetaxel-Resistenz aufweisen.
Aus den erfolgversprechenden Daten der sog. TROPIC Studie war bereits ein signifikanter Überlebensvorteil von Cabazitaxel gegenüber Mitoxantron gezeigt worden.7 Von daher war es nur konsequent, dieses Präparat in der Erstlinie gegen Docetaxel zu prüfen. Die Studie zeigt klar, dass Cabazitaxel der Erstlinie Docetaxel nicht überlegen ist.
Fazit
Cabazitaxel wurde für Patienten entwickelt, die eine klinische Docetaxel-Resistenz aufweisen. Aus den erfolgversprechenden Daten der sog. TROPIC Studie war bereits ein signifikanter Überlebensvorteil von Cabazitaxel gegenüber Mitoxantron gezeigt worden.7 Von daher war es nur konsequent, dieses Präparat in der Erstlinie gegen Docetaxel zu prüfen. Die Studie zeigt klar, dass Cabazitaxel der Erstlinie Docetaxel nicht überlegen ist.
Link zum Abstract: http://meetinglibrary.asco.org/content/166318-176
Taxan-Wechsel bei Patienten mit mCRCP (#5007)8
Welchen Einfluss ein früher Taxan-Wechsel nach CTC Biomarkerbestimmung auf den PSA-Verlauf bei Patienten mit chemo-naivem mRPC hat, sollte diese Phase-2-Studie untersuchen. Die Patienten wurden 2:1 nach Erstlinientherapie Docetaxel (D) vs. Cabazitaxel (C) randomisiert.
Wenn Patienten nicht bis zum vierten Behandlungszyklus mindestens eine PSA-Reduktion ≥ 30 % erreichten, fand der Wechsel auf das jeweils andere Regime statt. Bei Progression oder unerwünschten Nebenwirkungen wurde die Behandlung beendet. 63 Patienten randomisiert in D (N = 41) oder C (N = 22) nahmen teil. Ihr medianes Alter lag bei 71 Jahren. Weitere Parameter waren: ECOG PS ≤ 1 in 93,7 % und 44,4 % bekamen vorher antiandrogene Sekundär-Therapie. 33 Patienten (52,4 %; D 48,8 %, C 59,1 %) erreichten eine PSA-Reduktion von ≥ 30 % und wechselten somit nicht den Studienarm.
30 Patienten (47,6 %) erreichten nicht ≥ 30 % PSA-Reduktion. 15 Patienten dieser Gruppe (23,8 %; D 29,3 %, C 13,6 %) wechselten daraufhin den Studienarm, 8 der 15 Wechsel-Patienten (53,3%) erreichten danach ≥ 50 % PSA-Reduktion. 15 Patienten unterbrachen die Therapie. Insgesamt 35 Patienten (55,6 %) erreichten im Laufe der Studie eine ≥ 50 % PSA-Reduktion.
Fazit
Ein früher Wechsel auf das andere Taxan zeigt eine höhere PSA-Ansprechrate. Theoretisch macht vor allem der frühe Wechsel von D auf C Sinn, um einer möglichen Resistenzbildung vorzugreifen. Zu Bedenken ist jedoch, dass eine höhere PSA-Ansprechrate nicht immer mit einem besseren Überleben korrelieren muss.
Link zum Abstract: http://meetinglibrary.asco.org/content/169628-176
Nicht-Unterlegenheit von Cabazitaxel vs. Docetaxel beim mCRPC (PROSELICA-Studie) (#5008)9
Die TROPIC-Studie konnte eine signifikante Verbesserung des OS bei Cabazitaxel + Prednisolon (25 mg/m2 einmal in 3 Wochen + 10 mg oral täglich) vs. Mitoxantron + P (Hazard Ratio [HR] 0,70; P < 0,0001) nachweisen.7 Sie beobachtete Patienten mit mCRPC, die mit Docetaxel vorbehandelt waren. PROSELICA ist eine randomisierte, multifunktionale Phase-3-Studie, die Patienten mit mCRPC, ECOG 0-2 und Progress nach Behandlung mit Docetaxel einschließt. Die Randomisierung erfolgte 1:1 auf C20 oder C25. Ziel war, für C20 eine ≥ 50 % Effizienz-Verbesserung nachzuweisen. Als sekundäre Endpunkte waren PFS, Sicherheit, PSA, Schmerzen und QOL gesetzt. C20 ist C25 in Bezug auf OS bei Patienten mit mCRPC Progress nach Behandlung mit D nicht unterlegen und weist zugleich ein besseres Sicherheitsprofil auf. Fazit
Aus den Ergebnissen könnte ein klinisch relevantes Zweitlinien-Protokoll abgeleitet werden, denn die Toxizität von 20 mg/m2 Cabazitaxel ist deutlich geringer als die von 25 mg/m2.
Link zum Abstract: http://meetinglibrary.asco.org/content/169889-176
Genauigkeit von multiparametrischer MRT (mpMRT) und TRUS Biopsie bei Männern mit erhöhtem PSA (#5000)10
Der Stellenwert der mpMRT in der Primärindikation zur Prostatabiopsie eines Patienten mit erhöhtem PSA Wert ist unklar. PROMIS ist eine prospektive Kohortenstudie, die in 11 Zentren in UK durchgeführt wurde. Untersucht wurden mpMRT mit anschließender TRUS-Biopsie im Vergleich zu 5 mm Biopsien der Prostata (TPM-Biopsie). Die Ergebnisse wurden vor Auswertung verblindet.
Die Teilnehmer hatten PSA-Werte bis zu 15 ng/ml und vorher noch keine Biopsie erhalten. Im Zeitraum von 2012 bis 2015 wurden insgesamt 576 Männer untersucht. Mittels der Referenzmethode TPM-Biopsie konnte bei 230 Patienten (40 %) ein klinisch signifikantes PCa nachgewiesen werden. Beim mpMRT betrug die Sensitivität 93 % und die Spezifität 41 %. Der positiv prädiktive Wert (PPW) lag bei 51 % und der negativ prädiktive Werte (NPW) bei 89 %.
Die TRUS-Biopsie war mit 48 % signifikant weniger sensitiv als mpMRT und wies zugleich mit 74 % einen signifikant schlechteren NPW auf. Die Autoren schlussfolgern, dass durch ein initiales mpMRT bei etwa einem Viertel der Patienten eine Biopsie vermieden werden könnte, ohne ein klinisch signifikantes PCa zu übersehen.
Fazit
Es handelt sich nicht um eine randomisierte Studie zum Vergleich von TRUS-Biopsie vs. mpMRT Biopsie. Es ist zudem weiterhin unklar, ob ein mpMRT ein signifikantes Karzinom wirklich ausschließen kann. Die Qualität der TRUS-Biopsie kann nur im streng randomisierten Vergleich zur mpMRT-gestützten Biopsie verglichen werden.
Link zum Abstract: http://meetinglibrary.asco.org/content/163963-176
Ein 17-Gen Prostata-Score zur biochemischen und klinischen Rezidiv-Vorhersage beim Hoch-Risiko-PCa (#5049)11
Der Biopsie-basierte genomische Prostata-Score (GPS) ist ein validierter Prädiktor beim Niedrig- und Mittel-Risiko-PCa. In dieser Arbeit wurde der Zusammenhang zwischen einem 17-Gen GPS und dem biochemischen (BCR) bzw. klinischen Rezidiv (CR) beim Hoch-Risiko-PCa erforscht.
Untersucht wurden insgesamt N = 441 Tumoren nach radikaler Prostatektomie mit niedrigem, mittlerem und hohem Risikoprofil (AUA Score). Die Validierung erfolgte über eine unabhängige Kohorte von N = 139 Tumoren nach radikaler Prostatektomie. Die Studie zeigte, dass es eine breite Überlappung der GPS-Werte in allen drei Risiko-Gruppen gab. Der GPS war zudem stark mit BCR (HR 1,6/20 GPS, p < 0,001, FDR q-Wert < 0,1%) und CR assoziiert (HR 2,8/20 units, p < 0,001, FDR q-Wert < 0,1%). Tumoren mit mittlerem Risiko und GPS > 40 hatten ein ähnlich hohes Progressrisiko (BCR, CR) wie Hoch-Risiko-Tumoren.
Die Autoren schlussfolgern, dass ein GPS die Vorhersage für einen biochemischen oder klinischen Rezidiv in der Mittel-Risiko-Gruppe verbessern kann.
Fazit
Patienten mit intermediärem Risiko, aber hohem GPS wären Kandidaten für eine adjuvante Therapie.
Link zum Abstract: http://meetinglibrary.asco.org/content/167746-176
Decipher-Test (GC) zur Vorhersage des Risikos von Metastasen nach radikaler Prostatektomie (PRO-IMPACT Studie) (#5053)12
Die Entscheidung für eine adjuvante Therapie bei Hoch-Risiko-Patienten nach radikaler Prostatektomie ist von starken Unwägbarkeiten geprägt. Ziel der PRO-IMPACT Studie war es, mithilfe des etablierten GC-Tests hier mehr Sicherheit bei der Therapieentscheidung zu erlauben. Die Studie umfasste N = 150 Patienten mit pT3 oder positivem Absetzungsrand (R1) nach RP. Die beteiligten Ärzte dokumentierten ihre Therapieentscheidung jeweils vor und nach Durchführung des GC-Tests.
Ergebnisse von 141 Patienten mit einem medianen Alter von 64 Jahre flossen in die Studie ein. Die mediane 5 Jahres-Wahrscheinlichkeit für Metastasen nach dem GC-Test ermittelte für 48 % niedriges Risiko, 20 % mittleres Risiko und 32 % hohes Risiko. Vor dem GC-Test wurde für 88 % der Patienten Beobachtung empfohlen, für 12 % eine adjuvante Radiation (ART). Nach dem GC-Test wurden 18 % der Behandlungsempfehlungen geändert, insbesondere bei 31 % der Hoch-Risiko-Patienten.
Die Autoren halten fest, dass die Entscheidung für oder gegen eine ART durch den GC-Test qualitativ beeinflusst wurde. Dabei wurde für Niedrig-Risiko-Patienten eher Beobachtung empfohlen, für Hoch- Risiko-Patienten eher ART.
Fazit
Molekulare Tests können bereits jetzt die Genauigkeit der Prognose des Patienten nach radikaler Prostatektomie verbessern.
Link zum Abstract: http://meetinglibrary.asco.org/content/162383-176
Verlängert Docetaxel das biochemisch krankheitsfreie Überleben (BDFS) nach radikaler Prostatektomie bei Patienten mit PCa und hohem Risiko? (#5001)13
Docetaxel kann das Überleben bei fortgeschrittenem CRPC verlängern. Diese Studie sollte klären, ob 6 Zyklen mit Docetaxel das BDFS nach radikaler Prostatektomie beim Hoch-Risiko-PCa verbessern.
Hierzu wurden N = 459 Patienten von 2005-2010 für diese multinationale openlabel Phase 3 Studie rekrutiert. Im Arm A erhielten die Teilnehmer 6 Zyklen Docetaxel 75 mg/m2, in Arm B erfolgte Überwachung. Primärer Endpunkt war PSA Rezidiv > 0,5 ng/ml. Hoch-Risiko-PCa war dabei definiert als
- pT2 + R1 bei RP Präparaten mit GS 4+3 oder höher
- pT3b > GS 3+4
- positive Lymphknoten und > GS 3+4
Das Follow-up erfolgte über 5 Jahre mit einer PSA-Messung alle 3 Monate. 79 % der Patienten beendeten alle 6 Zyklen. Dabei wurde der Endpunkt von 43,2 % der Patienten erreicht, wobei es keine behandlungsbedingten Todesfälle gab. Eine Kaplan-Meier Analyse zeigte keine signifikanten Unterschiede zwischen beiden Studienarmen.
Die Autoren leiten daraus ab, dass eine adjuvante Therapie mit Docetaxel ohne Hormontherapie das biochemische Rezidiv nach RP im Vergleich zur Überwachung der Patienten nicht signifikant verhindern konnte.
Fazit
Ähnlich wie schon von Morris et al., im Rahmen des ASCO Kongress 2015, gezeigt, (ADT +/- Docetaxel) kann eine adjuvante Therapie mit Docetaxel das biochemische Rezidiv nicht verhindern.14
Link zum Abstract: http://meetinglibrary.asco.org/content/166934-176
Einfluss von Enzalutamid (ENZA) auf eine neoadjuvante Therapie mit der Kombination von LHRH Analoga mit Abirateron (AA) bei Hoch-Risiko-Patienten vor radikaler Prostatektomie (#5002)15
Die neoadjuvante Therapie von Patienten mit Prostatakarzinom vor radikaler Prostatektomie ist umstritten. Diese randomisierte Studie untersucht den Einfluss von ENZA auf eine neoadjuvante Therapie.
Hierzu wurde eine neoadjuvante Therapie über 24 Wochen vor RP durchgeführt. Die Patienten wurden randomisiert 2:1 in die Therapie- gruppen AA + LHRHa + ENZA und AA + LHRHa aufgeteilt. Eine Anzahl von N = 65 Patienten erhielten im Anschluss an die neoadjuvante Therapie auch eine Prostatektomie.
Die Ergebnisse bzgl. des pathologischen Downstaging und der Reduktion des PSA Nadir sind in Tabelle 2 dargestellt:
Tabelle 2: Pathologisches Downstaging und PSA Nadir in den beiden Studienarmen15
Aus diesen Ergebnissen leiten die Autoren ab, dass die Zugabe von ENZA zur neoadjuvanten Therapie mit AA + LHRHa bei lokal begrenztem PCa mit hohem Progressionsrisiko nicht empfohlen wird.
Fazit
Der Stellenwert der neoadjuvanten Therapie bei lokalisiertem PCa bleibt nach wie vor umstritten. Interessant an dieser Studie ist, dass die Kombination von ENZA und AA die biologische Wirkung am Tumor eher verschlechtert als eine Therapie mit AA + LHRHa alleine.
Link zum Abstract: http://meetinglibrary.asco.org/content/169254-176
Kurzzeitbestrahlung beim lokalisierten PCa (#5003)16
Die klassische Bestrahlung von Patienten mit kurativ behandelbarem PCa umfasst üblicherweise eine hoch dosierte Radiotherapie (RT) für 8 – 9 Wochen. Die Autoren dieser Studie wollten die Frage klären, ob eine 8 Wochen dauernde RT bei Patienten mit intermediärem Risiko durch Hypofraktionierung sicher auf eine Dauer von 4 Wochen reduziert werden kann.
Für die Studie wurden Männer mit PCa und intermediärem Risiko randomisiert auf zwei Studienarme aufgeteilt. Arm A beinhaltete eine konventionelle (CON) RT (78 Gy in 39 Fraktionen für 8 Wochen), Arm B die hypofraktionierte (HYP) RT (60 Gy in 20 Fraktionen für 4 Wochen). Primärer Endpunkt war das biochemische/klinische Versagen der Therapie (BCF), definiert durch: PSA Rezidiv (Nadir+2), Hormontherapie aufgrund von klinischem oder lokalem Versagen oder Tod.
Zwischen 2006 und 2011 wurden N = 1.206 Männer aus Kanada, Australien und Frankreich mit einem Durchschnittsalter von 71 Jahren beobachtet. 608 erhielten HYP, 598 CON. Das mediane FU lag bei 6 Jahren. Die Anzahl Patienten, die bis dato BCF erlitten haben, beträgt 164 für HYP und 173 für CON. Die BCF-Rate in beiden Armen beträgt nach 5 Jahren 21 % (HR 0,69, 90 % CI, 0,8-1,15). 75 Patienten starben in beiden Gruppen (12 %). Die Spättoxizität (Grad 3 und höher) lag für HYP bei 3,5 % für CON bei 5,4 %.
Die Autoren bilanzieren, dass die hypofraktionierte Bestrahlung über 4 Wochen bei Patienten mit PCa und mittlerem Progress-Risiko der konventionellen Bestrahlung über 8 Wochen nicht unterlegen ist.
Fazit
Die Rezidivrate bei Patienten mit kurativer Bestrahlung und intermediärem Risiko liegt bereits nach 6 Jahren bei 21 %, unabhängig vom Bestrahlungsregime. Eine Reduzierung der Bestrahlungsdauer von 4 auf 8 Wochen wäre ein erheblicher Vorteil für die Patienten.
Link zum Abstract: http://meetinglibrary.asco.org/content/165234-176
Wie sehr unterscheiden sich Patienten mit mCRPC abhängig vom Metastasen-Status bei der Erstdiagnose? (#5024)17
Das Prostatakrebsregister (NCT02236637) umfasst mehr als 3.000 mCRPC-Patienten aus 199 klinischen Zentren in 16 europäischen Ländern. Daten der Zwischenauswertung Europas erster und größter prospektiver Studie zu Patienten mit mCRPC deuten darauf hin, dass das Vorhandensein von Fernmetastasen (M1) im Rahmen der Erstdiagnose ein wichtiger Indikator für künftige Behandlungen und Prognosen für mCRPC-Patienten sein kann.
Die Daten beschreiben Merkmale zu Studienbeginn bei Männern mit mCRPC, bei denen im Rahmen der Erstdiagnose Fernmetastasen (M1) festgestellt wurden, im Vergleich mit Patienten, deren Karzinome bei der Erstdiagnose keine Metastasierungen aufwiesen (M0). Die Daten belegten einen höheren PSA-Spiegel, vermehrtes Auftreten von Knochenläsionen und leichte Funktionseinschränkungen im Hinblick auf die Fähigkeit, für sich selbst zu sorgen, Alltagsaktivität und körperliche Fähigkeit (gemäß ECOG-Index) bei M1-Patienten im Vergleich mit M0-Patienten. Im Rahmen dieser Auswertung wurden Daten von 1.323 Patienten mit mCRPC ausgewertet, darunter 549 in M1 (41,5 %) und 526 in M0 (39,8 %) bei Erstdiagnose, sowie 248 Männer, deren Stadium bei der Erstdiagnose nicht bestimmt werden konnte (Mx, 18,7 %).
Wie Tabelle 3 zeigt, war der PSA-Wert für M1-Patienten um 34,4 % höher als bei M0-Patienten.
Tabelle 3: PSA-Wert, Knochenläsionen und ECOG-Indes bei M1 vs. M0-Patienten17
Das Vorhandensein von (mehr als 5) Knochenläsionen war bei M1 vs. M0 um 24 % erhöht. Zudem war auch der ECOG-Index (> 2) erhöht.
Fazit
Die Nachbeobachtung dieser Patienten wird im Laufe der Zeit klären, wie diese klinischen Unterschiede und nachfolgende Behandlungen die klinischen Ergebnisse beeinflussen können.
(1) Balar A V, et al. Atezolizumab (atezo) as first-line (1L) therapy in cisplatin-ineligible locally advanced/metastatic urothelial carcinoma (mUC): Primary analysis of IMvigor210 cohort 1. J Clin Oncol 34, 2016 (suppl; abstr LBA4500)
(2) Massard C, et al. Safety and efficacy of durvalumab (MEDI4736), a PD-L1 antibody, in urothelial bladder cancer. J Clin Oncol 34, 2016 (suppl; abstr 4502)
(3) Geschwend J E, et al. Limited versus extended pelvic lymphadenectomy in patients with bladder cancer undergoing radical cystectomy: Survival results from a prospective, randomized trial (LEA AUO AB 25/02). München (Deutschland) – oral presentation
(4) Patrick-Miller L J, et al. Quality of life (QOL) analysis from CHAARTED: Chemohormonal androgen ablation randomized trial in prostate cancer (E3805). J Clin Oncol 34, 2016 (suppl; abstr 5004)
(5) Cash H, et al. PRINCE: A phase III study comparing intermittent docetaxel therapy versus continuous docetaxel therapy in patients with castration-resistant prostate cancer. J Clin Oncol 34, 2016 (suppl; abstr 5005)
(6) Sartor A O, et al. Cabazitaxel vs docetaxel in chemotherapy-naive (CN) patients with metastatic castration-resistant prostate cancer (mCRPC): A three-arm phase III study (FIRSTANA). J Clin Oncol 34, 2016 (suppl; abstr 5006)
(7) de Bono J S, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet. 2010 Oct 2;376(9747):1147-54. doi: 10.1016/S0140-6736(10)61389-X.
(8) Tagawa S T, et al. TAXYNERGY: Randomized trial of early switch from first-line docetaxel (D) to cabazitaxel (C) or vice versa with circulating tumor cell (CTC) biomarkers in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 34, 2016 (suppl; abstr 5007)
(9) de Bono J S, et al. Phase III non-inferiority study of cabazitaxel (C) 20 mg/m2 (C20) versus 25 mg/m2 (C25) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) previously treated with docetaxel (D). J Clin Oncol 34, 2016 (suppl; abstr 5008)
(10) Ahmed H U, et al. The PROMIS study: A paired-cohort, blinded confirmatory study evaluating the accuracy of multi-parametric MRI and TRUS biopsy in men with an elevated PSA. J Clin Oncol 34, 2016 (suppl; abstr 5000)
(11) Klein E A, et al. A 17-gene genomic prostate score (GPS) as a predictor of biochemical (BCR) and clinical recurrence (CR) in men with surgically treated intermediate- and high-risk prostate cancer (PCa). J Clin Oncol 34, 2016 (suppl; abstr 5049)
(12) Gore J L, et al. Effect of a genomic classifier on adjuvant treatment decision-making among patients with high-risk pathology at radical prostatectomy: Results from the multicenter prospective PRO-IMPACT study. J Clin Oncol 34, 2016 (suppl; abstr 5053)
(13) Ahlgren G, et al. A randomized phase III trial between adjuvant docetaxel and surveillance after radical prostatectomy for high risk prostate cancer: Results of SPCG12. J Clin Oncol 34, 2016 (suppl; abstr 5001)
(14) Morris M J, et al. Effects of radium-223 dichloride (Ra-223) with docetaxel (D) versus D on prostate-specific antigen (PSA) and bone alkaline phosphatase (bALP) in patients (pts) with castration-resistant prostate cancer (CRPC) and bone metastases (mets): A phase 1/2a clinical trial. J Clin Oncol 33, 2015 (suppl 7; abstr 202)
(15) Efstathiou E, et al. Neoadjuvant enzalutamide (ENZA) and abiraterone acetate (AA) plus leuprolide acetate (LHRHa) versus AA+ LHRHa in localized high-risk prostate cancer (LHRPC). J Clin Oncol 34, 2016 (suppl; abstr 5002)
(16) Catton C N, et al. A randomized trial of a shorter radiation fractionation schedule for the treatment of localized prostate cancer. J Clin Oncol 34, 2016 (suppl; abstr 5003)
(17) Chowdhury S, et al. The Prostate Cancer Registry: Do patients with metastatic castration-resistant prostate cancer (mCRPC) differ according to metastatic status at diagnosis? J Clin Oncol 34, 2016 (suppl; abstr 5024)