Wo liegen die Ursachen des kardiovaskulären Risikos bei der Androgendeprivationstherapie?
Frau Dr. med. Yamini Nagaraj
Fachärztin für Urologie
Zusatzbezeichnung: Fellow of the European Board of Urology (FEBU)
Martini-Klinik am UKE GmbH
Martinistraße 52
20246 Hamburg
Einleitung
Die Androgendeprivationstherapie (ADT) stellt eine etablierte und wirkungsvolle Therapieoption für Patienten mit lokal fortgeschrittenem oder metastasiertem Prostatakarzinom dar. Zusätzlich erhält eine steigende Anzahl von Patienten mit lokalisiertem Prostatakarzinom diese Therapie. Faktisch sind es etwa 45 % aller Prostatakarzinompatienten, die irgendwann im Verlauf ihrer Erkrankung mit einer ADT behandelt werden.
Die ADT erhöht das Überleben in bestimmten Konstellationen des Prostatakarzinoms, in Kombination mit der Bestrahlung bei Hochrisikopatienten oder nach Prostatektomie bei lymphknoten-positiven Patienten. Parallel dazu ist sie mit einem nicht zu vernachlässigenden Nebenwirkungsprofil verbunden. Hier wird vor allem das erhöhte Risiko kardiovaskulärer (CV) Ereignisse wie KHK (koronare Herzkrankheit), akuter Myokardinfarkt und plötzlicher Herztod immer wieder genannt.
Die Studie von Gandaglia et al.1 untersuchte nun explizit die Auswirkung einer ADT mit LHRH-Analoga auf das KHK-Risiko bei Prostatakarzinompatienten. Dabei wurde insbesondere auch untersucht, ob die Orchiektomie, die ebenfalls eine Androgendeprivation bewirkt, eine sicherere Alternative zur ADT darstellt. Ihre Autoren kamen dabei zu dem Ergebnis, dass die LHRH-Analoga-Therapie mit einer signifikanten Steigerung des Risikos für KHK, akuten Myokardinfarkte und plötzlichen Herztode einhergeht. Bei der zum Vergleich herangezogenen bilateralen Orchiektomie war kein erhöhtes kardiovaskuläres Risiko festzustellen.
LHRH-Analoga bewirken ein signifikant höheres CV-Risiko
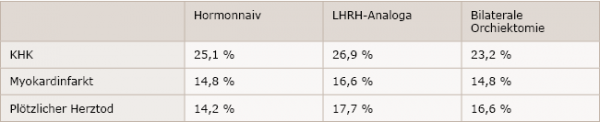
Eingeschlossen wurden 140.474 Patienten aus der SEER-Datenbank (Surveillance, Epidemiology, and End Results, National Cancer Institute), bei denen eine bestehende KHK (nach ICD-Kriterien) ausgeschlossen war. Von diesen erhielten 57.939 Patienten eine ADT mit LHRH-Analoga, 2.055 eine bilaterale Orchiektomie und 80.479 Patienten blieben hormonnaiv. Aus der nachfolgenden Beobachtung über einen Zeitraum von 75 Monaten ging hervor, dass insgesamt 49.390 Patienten einen kardialen Zwischenfall (KHK, Myokardinfarkt oder plötzlichen Herztod) erlitten, während 35.060 am Prostatakarzinom oder an einer anderen Ursache verstarben. Wie Tabelle 1 zeigt, standen Patienten in der Therapie mit LHRH-Analoga in Relation zu hormonnaiven Patienten nach 10 Jahren unter einem signifikant erhöhten Risiko für kardiovaskuläre Ereignisse wie KHK, Myokardinfarkt oder plötzlicher Herztod (alle P < 0,001). Bei Patienten, die einer bilateralen Orchiektomie unterzogen wurden, war das Risiko nicht signifikant erhöht (alle P ≥ 0,7).
Tabelle 1: 10 Jahres-Raten des Risikos kardiovaskulärer Ereignisse bei Prostatakarzinompatienten (nach Gandaglia et al.1)
Wo liegen die Ursachen des kardiovaskulären Risikos?
Historisch gesehen wurde der Zusammenhang zwischen kardialer Morbidität und der ADT im niedrigen Testosteronspiegel gesehen, welcher zu metabolisch bedingter Insulinresistenz und Übergewicht führt. Zusätzlich sollen die niedrigen Testosteronspiegel die kardiale Kontraktilität beeinträchtigen und zu einer Zunahme der Arterienwanddicke und einer endothelialen Dysfunktion führen und so schließlich arteriosklerotische Plaquebildung begünstigen.2,3 Inzwischen gibt es mehrere Arbeiten, die einen anderen Mechanismus postulieren, nämlich, dass LHRH-Analoga die kardiale Kontraktilität direkt durch GnRH-Rezeptoren beeinflussen, exprimiert von Kardiomyozyten. Zusätzlich exprimieren T-Zellen auch GnRH-Rezeptoren, die durch LHRH-Analoga eine Destabilisierung der arteriosklerotischen Plaques und deren Ruptur triggern und so als Folge möglicherweise kardiale Ereignisse auslösen.4,5 Diese spezifischen Vorgänge, die die Verknüpfung zwischen GnRH-Analoga und kardiovaskulärer Morbidität erklären, müssen jedoch noch eingehender untersucht werden.
Als Einschränkung der Studie von Gandaglia1 ist das retrospektive Design zu sehen. Darüber hinaus ist ein gewisser Bias bei der Therapieselektion nicht auszuschließen. Des Weiteren gibt es keine Daten über bestimmte Risikofaktoren wie Rauchen, BMI oder KHK in der Familienanamnese. Außerdem handelt es sich um Patienten, die ausschließlich 66 Jahre oder älter sind. Deshalb sind die Ergebnisse nicht ohne weitere Nachweise auf jüngere Patienten zu übertragen.
Daher ist es von Bedeutung, alternative Therapien zu finden, die die erwünschte Testosteronsuppression erreichen, jedoch geringere kardiovaskuläre Risiken mit sich bringen und gleichzeitig das Stigma der chirurgischen Kastration vermeiden.
(1) Gandaglia G, Sun M, Popa I, Schiffmann J. The Impact of Androgen Deprivation Therapy on the Risk of Coronary Heart Disease in Patients with Non-Metastatic Prostate cancer: a Population based Study. BJU Int. 2014 Dec;114(6b):E82-9. doi: 10.1111/bju.12732. Epub 2014 Jul 27.
(2) Fahed AC, Gholmieh JM, Azar ST. Connecting the Lines between Hypogonadism and Atherosclerosis.Int. Jou. Of Endocrinology 2012. Volume 2012.Article ID 793953. Available at: http://www.hindawi.com/journals/ije/2012/793953/
(3) Liu PY, Death AK, Handelsman DJ. Androgens and cardiovascular disease. Endocr Rev. 2003 Jun;24(3):313-40.
(4) Chen HF, Jeung EB, Stephenson M, Leung PC. Human peripheral blood mononuclear cells express gonadotropin-releasing hormone(GnRH), GnRH receptor, and interleukin-2 receptor gamma chain mRNA that are regulated by GnrH in vitro. J Clin Endocrinol Metab. 1999 Feb;84(2):743-50
(5) Tanriverdi F, Gonzalez-Martinez D, Hu Y, Kelestimur F, Bouloux PM. GnRH-I and GnRH-II have differential modulatory effects on human peripheral bloodmononuclear cell proliferation and interleukin-2 receptor gamma chain mRNA in healthy males. Clin Exp Immunol. 2005 Oct;142(1):103-10










